Die biomedizinischen Ingenieure von Duke hoffen, dass ein neues Gerät den Alzheimer-Biomarker erkennen könnte
Veröffentlichungsdatum: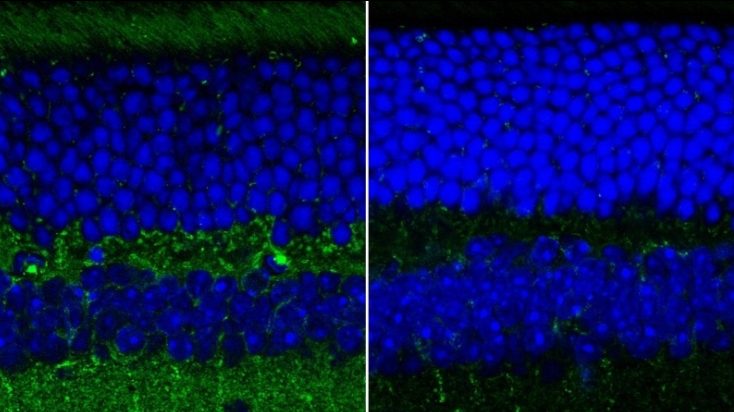
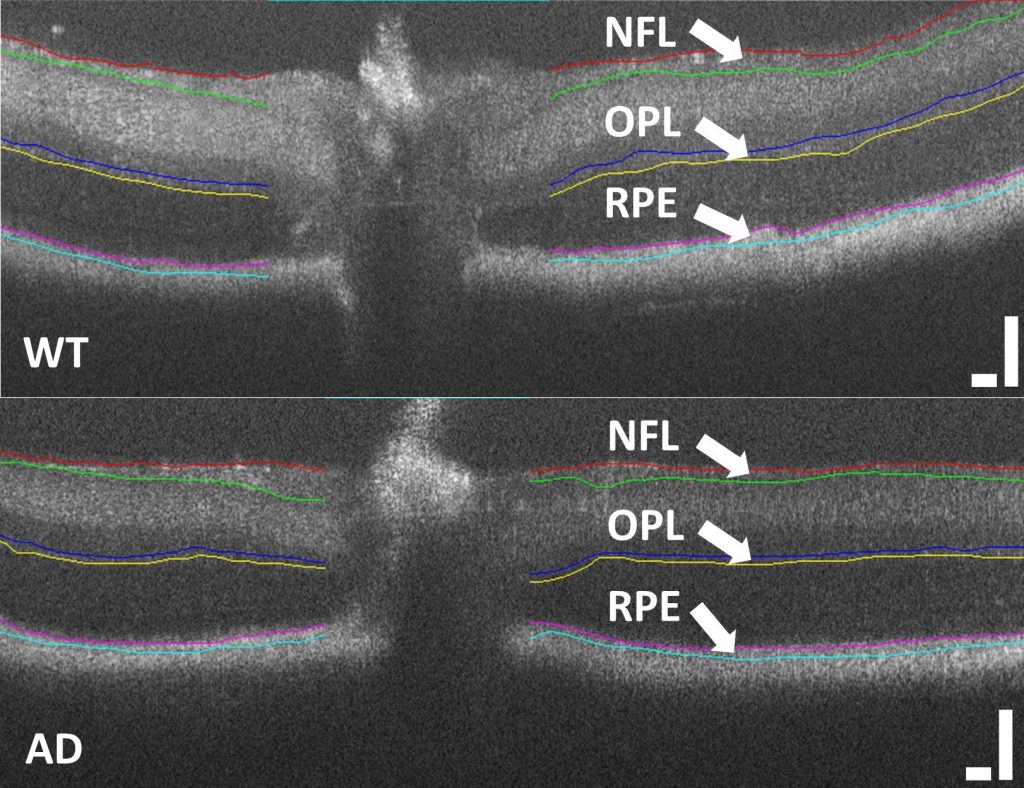
DURHAM – Biomedizinische Ingenieure der Duke University haben ein neues bildgebendes Gerät entwickelt, mit dem sich sowohl die Dicke als auch die Beschaffenheit der verschiedenen Schichten der Netzhaut im hinteren Teil des Auges messen lässt. Dieser Fortschritt könnte zur Erkennung eines Biomarkers für Alzheimer eingesetzt werden und so möglicherweise ein weitverbreitetes Frühwarnsystem für die Krankheit bieten.
Die Ergebnisse erscheinen online in der Zeitschrift Scientific Reports.
„Frühere Studien haben eine Ausdünnung der Netzhaut bei Alzheimer-Patienten festgestellt, aber durch die Hinzufügung einer Lichtstreuungstechnik zur Messung haben wir festgestellt, dass die Nervenfaserschicht der Netzhaut auch rauer und ungeordneter ist“, sagte Adam Wax, Professor für Biomedizintechnik an der Duke University. „Wir hoffen, dass wir diese Erkenntnisse nutzen können, um ein einfaches und kostengünstiges Screening-Gerät zu entwickeln, das nicht nur in der Arztpraxis, sondern auch in Ihrer örtlichen Apotheke erhältlich wäre.“
Die Diagnose Alzheimer wird derzeit erst gestellt, wenn bei einem Patienten Symptome kognitiver Beeinträchtigungen auftreten. Selbst dann kann nur durch teure MRT- und PET-Scans oder eine Autopsie eindeutig festgestellt werden, ob Alzheimer die Ursache war. Wenn der Krankheitsverlauf jedoch durch frühzeitige Interventionen wie Medikamente und geistiges Training aufgehalten werden kann, kann sich die Lebensqualität der Patienten erheblich verbessern. Aus diesem Grund suchen Forscher nach Biomarkern, die als Frühwarnzeichen der Krankheit eingesetzt werden könnten.
Ein solcher potenzieller Biomarker stammt aus der Netzhaut, die buchstäblich eine Erweiterung des Gehirns und Teil des zentralen Nervensystems ist. Frühere Forschungen haben gezeigt, dass Alzheimer strukturelle Veränderungen der Netzhaut verursachen kann, insbesondere eine Ausdünnung der inneren Netzhautschichten.
„Die Netzhaut bietet einen einfachen Zugang zum Gehirn und ihre Ausdünnung kann auf eine Abnahme des Nervengewebes hinweisen, was wiederum auf Alzheimer hindeuten kann“, sagte Wax.
Andere Krankheiten wie Glaukom und Parkinson können jedoch auch eine Ausdünnung der Netzhaut verursachen. Uneinheitliche Testergebnisse können auch auf Unterschiede zwischen den am häufigsten für diese Art von Messungen verwendeten Geräten, optischen Kohärenztomographiegeräten (OCT), und der Art und Weise zurückzuführen sein, wie Forscher sie verwenden.
In der neuen Arbeit zeigen Wax und sein Doktorand Ge Song, dass die oberste Schicht von Neuronen in der Netzhaut eines Mausmodells der Alzheimer-Krankheit eine Veränderung ihrer Strukturstruktur aufweist. In Kombination mit Daten über die Veränderungen der Dicke dieser Schicht könnte sich die neue Messung als leichter zugänglicher Biomarker für Alzheimer erweisen.
„Mit unserem neuen Ansatz können wir die Rauheit oder Beschaffenheit der Nervenfaserschicht der inneren Netzhaut messen“, sagte Song. „Er bietet eine schnelle und direkte Möglichkeit, die durch Alzheimer verursachten Strukturveränderungen zu messen, was großes Potenzial als Biomarker der Krankheit hat.“
OCT ist das optische Analogon zum Ultraschall. Dabei werden Lichtwellen in das Gewebe gesendet und gemessen, wie lange es dauert, bis sie zurückkehren. Obwohl es sich um eine äußerst nützliche Bildgebungstechnik handelt, die häufig für eine Vielzahl von Diagnosen verwendet wird, weist sie Einschränkungen auf.
Um mehr Daten zu sammeln, fügten Wax und Song eine Messung namens winkelaufgelöste Niedrigkohärenzinterferometrie (a/LCI) hinzu, die die Winkel des gestreuten Lichts nutzt, um mehr Informationen über die Struktur des Gewebes zu sammeln. Durch die Kombination der beiden Messungen können die Forscher sowohl Dicken- als auch Strukturinformationen über jede Schicht der Netzhaut extrahieren.
„Die a/LCI-Messungen ergänzen die Dickenmessungen, um den potenziellen Nutzen quantitativer Biomarker für Alzheimer zu verbessern“, sagte Song. „Mit OCT allein kann man keine Textur- und Strukturinformationen über die Netzhaut erhalten. Man braucht beide Bildgebungsverfahren. Das ist die entscheidende Innovation.“
Die Forscher arbeiten nun daran, diese zusätzliche Fähigkeit in ein kostengünstiges OCT-System zu integrieren, das Wax über ein Spin-off-Unternehmen namens Lumedica entwickelt. Während herkömmliche OCT-Geräte mehr als 60 Pfund wiegen, einen ganzen Schreibtisch einnehmen und zwischen $50.000 und $120.000 kosten, wiegt Wax‘ Design vier Pfund, ist etwa so groß wie eine Lunchbox und wird, so erwartet Wax, für weniger als $15.000 verkauft werden.
Der Schlüssel zu Wax‘ Design ist ein 3D-gedrucktes Teil, das Symmetrie nutzt, um mechanische Inkonsistenzen auszugleichen, die bei herkömmlichen OCT-Geräten durch Dinge wie eine geringfügige Temperaturänderung entstehen können. Song hat außerdem an einem 3D-gedruckten Rotationsprisma gearbeitet, mit dem das a/LCI die gesamte Netzhaut scannen kann.
„Wir sind begeistert, weil diese Forschung eine neue Möglichkeit zeigt, kostengünstige OCT-Technologien über das reine Screening auf herkömmliche Netzhauterkrankungen hinaus einzusetzen“, sagte Wax. „Wenn wir diese Geräte als Fenster zu frühen Anzeichen neurodegenerativer Erkrankungen nutzen können, können wir Menschen vielleicht dabei helfen, an einem Frühinterventionsprogramm teilzunehmen, bevor es zu spät ist.“
Diese Forschung wurde von den National Institutes of Health (R21AG056245, P30EY005722) unterstützt.
ZITATION: „Multimodale kohärente Bildgebung von retinalen Biomarkern der Alzheimer-Krankheit in einem Mausmodell“, Ge Song, Zachary A. Steelman, Stella Finkelstein, Ziyun Yang, Ludovic Martin, Kengyeh K. Chu, Sina Farsiu, Vadim Y. Arshavsky, Adam Wax. Scientific Reports, 13. Mai 2020. DOI: 10.1038/s41598-020-64827-2.
Originalquelle des Artikels: WRAL TechWire
